Kimya öğretmeni el kitabı. Çözeltilerle kimyada Birleşik Devlet Sınavı görevleri: Çeşitli inorganik madde sınıfları arasındaki ilişki Potasyum iyodür, aşırı klorlu su ile işlemden geçirildi
su oluşumu. Gazların sudan geçirilmesiyle elde edilen çözelti asidikti. Bu çözelti gümüş nitratla işlendiğinde 14,35 g beyaz bir çökelti oluştu. İlk gaz karışımının niceliksel ve niteliksel bileşimini belirleyin. Çözüm.
Yanarak su oluşturan gaz hidrojendir; suda az çözünür. Oksijenli hidrojen ve klorlu hidrojen güneş ışığında patlayıcı bir şekilde reaksiyona girer. Hidrojen karışımında klorun olduğu açıktır, çünkü elde edilen HC1 suda oldukça çözünür ve AgN03 ile beyaz bir çökelti verir.
Böylece karışım H2 ve C1 gazlarından oluşur:
1 mol 1 mol
HC1 + AgN03 -» AgCl 4- HN03.
x mol 14,35
1 mol HC1 muamele edildiğinde 1 mol AgCl oluşur ve x mol muamele edildiğinde 14,35 g veya 0,1 mol oluşur. Mr(AgCl) = 108 + 2 4- 35,5 = 143,5, M(AgCl) = 143,5 g/mol,
v= - = = 0,1 mol,
x = 0,1 mol HC1 çözeltide bulunuyordu. 1 mol 1 mol 2 mol H2 4- C12 2HC1 x mol y mol 0,1 mol
x = y = 0,05 mol (1,12 l) hidrojen ve klor reaksiyona girerek 0,1 mol oluşturdu
NS1. Karışım 1,12 litre klor ve 1,12 litre hidrojen + 1,12 litre (fazla) = 2,24 litre içeriyordu.
Örnek 6. Laboratuarda sodyum klorür ve sodyum iyodür karışımı bulunmaktadır. Bu karışımın 104.25 g'ı su içinde çözüldü ve fazla klor, elde edilen çözeltiden geçirildi, ardından çözelti kuruyana kadar buharlaştırıldı ve tortu, 300°C'de sabit ağırlığa kadar kalsine edildi.
Kuru madde kütlesinin 58,5 g olduğu ortaya çıktı. Başlangıç karışımının bileşimini yüzde olarak belirleyin.
Mr(NaCl) = 23 + 35,5 = 58,5, M(NaCl) = 58,5 g/mol, Mr(Nal) = 127 + 23 = 150 M(Nal) = 150 g/mol.
İlk karışımda: NaCl kütlesi - x g, Nal kütlesi - (104.25 - x) g.
Sodyum klorür ve iyodür bir çözeltiden geçirildiğinde iyotun yerini alır. Kuru kalıntı içinden geçirildiğinde iyot buharlaştı. Bu nedenle yalnızca NaCl kuru bir madde olabilir.
Ortaya çıkan maddede: başlangıçtaki NaCl kütlesi x g, sonuçtaki kütle (58,5-x):
2 150 gr 2 58,5 gr
2NaI + C12 -> 2NaCl + 12
(104,25 - x) g (58,5 - x) g
2,150 (58,5 - x) = 2,58,5 (104,25-x)
x = - = 29,25 (g),
onlar. Karışımdaki NaCl 29,25 g ve Nal - 104,25 - 29,25 = 75 (g) idi.
Karışımın bileşimini bulalım (yüzde olarak):
w(Nal) = %100 = %71,9,
©(NaCl) = %100 - %71,9 = %28,1.
Örnek 7 68.3 g nitrat, iyodür ve potasyum klorür karışımı su içinde çözüldü ve klorlu su ile işlendi. Sonuç olarak, 25,4 g iyot açığa çıktı (sudaki çözünürlüğü ihmal edildi). Aynı çözelti gümüş nitratla işlendi. 75,7 gr çökelti düştü. İlk karışımın bileşimini belirleyin.
Klor, potasyum nitrat ve potasyum klorür ile etkileşime girmez:
2KI + C12 -» 2KS1 + 12,
2 mol - 332 gr 1 mol - 254 gr
Mg(K1) = 127 + 39 - 166,
x = = 33,2 g (KI karışımın içindeydi).
v(KI) - - = = 0,2 mol.
1 mol 1 mol
KI + AgN03 = Agl + KN03.
0,2 mol x mol
x = = 0,2 mol.
Bay(Agl) = 108 + 127 = 235,
m(Agl) = Mv = 235 0,2 = 47(r),
o zaman AgCl olacak
75,7 gr - 47 gr = 28,7 gr.
74,5 gr 143,5 gr
KCl + AgN03 = AgCl + KN03
X = 1 L_ = 14,9 (KCI).
Dolayısıyla karışım şunları içeriyordu: 68,3 - 33,2 - 14,9 = 20,2 g KN03.
Örnek 8. 34,5 g oleumu nötralize etmek için 74,5 ml %40'lık potasyum hidroksit çözeltisi tüketilir. 1 mol sülfürik asit başına kaç mol sülfür oksit (VI) vardır?
%100 sülfürik asit, sülfür oksidi (VI) herhangi bir oranda çözer. H2S04*xS03 formülüyle ifade edilen bileşime oleum adı verilir. H2S04'ü nötralize etmek için ne kadar potasyum hidroksite ihtiyaç duyulduğunu hesaplayalım:
1 mol 2 mol
H2S04 + 2KON -> K2S04 + 2Н20 xl mol y mol
y - 2*x1 mol KOH, oleumdaki S03'ü nötrleştirmeye gider. 1 mol S03'ü nötralize etmek için ne kadar KOH gerektiğini hesaplayalım:
1 mol 2 mol
S03 4- 2KOH -> K2SO4 + H20 x2 mol z mol
z - 2 x2 mol KOH, oleumdaki SOg'u nötralize etmeye gider. Oleumu nötralize etmek için 74,5 ml %40 KOH çözeltisi kullanılır; 42 g veya 0,75 mol KOH.
Dolayısıyla 2 xl + 2x 2 = 0,75,
98 xl + 80 x2 = 34,5 gr,
xl = 0,25 mol H2S04,
x2 = 0,125 mol S03.
Örnek 9 Kalsiyum karbonat, çinko sülfit ve sodyum klorürden oluşan bir karışım mevcuttur. Bu karışımın 40 g'ı aşırı hidroklorik asite maruz bırakılırsa, 6,72 litre gaz açığa çıkacak ve bu, aşırı kükürt (IV) oksitle etkileşime girdiğinde 9,6 g çökelti açığa çıkaracaktır. Karışımın bileşimini belirleyin.
Karışım aşırı hidroklorik asite maruz kaldığında karbon monoksit (IV) ve hidrojen sülfit açığa çıkabildi. Yalnızca hidrojen sülfit, kükürt (IV) oksitle reaksiyona girer, dolayısıyla hacmi, salınan çökelti miktarından hesaplanabilir:
CaC03 + 2HC1 -> CaC12 + H20 + C02t(l)
100 g - 1 mol 22,4 l - 1 mol
ZnS + 2HC1 -> ZnCl2 + H2St (2)
97 g - 1 mol 22,4 l - 1 mol
44,8 l - 2 mol 3 mol
2H2S + S02 -» 3S + 2H20 (3)
xl l 9,6 g (0,3 mol)
xl = 4,48 1 (0,2 mol) H2S; denklemlerden (2 - 3) ZnS'nin 0,2 mol (19,4 g) olduğu açıktır:
2H2S + S02 -> 3S + 2H20.
Karışımdaki karbon monoksitin (IV) şu şekilde olduğu açıktır:
6,72 l - 4,48 l = 2,24 l (C02).
Çözüm:
2Cl2 + 2H2O = 4HCl + O2
mp-pa = m(H2O) + m(Cl2) – m(O2) ;
Δm = m(Cl2) – m(O2) ;
n(Cl2)'yi şöyle alalım: X n(O2) = 0,5x;
Yukarıdaki eşitliğe dayalı bir cebirsel denklem oluşturalım ve bulalım. X:
Δm = x M(Cl2) − 0,5x M(O2) = x(71 − 16) = 55x;
x = 0,04 mol;
V(Cl2) = n(Cl2) Vm = 0,004 22,4 = 0,896 l.
Cevap: 0,896 l.
10. 10.0 g demir ve bakır karışımının tamamen klorlanması için gerekli olan klor hacminin (no.) izin verilen değerlerinin aralığını hesaplayın.
Çözüm:
Koşul, karışımdaki metallerin oranının ne olduğunu söylemediğinden, yalnızca bu durumda klor hacmi için izin verilen değer aralığının, her birinin 10 g'ını klorlamak için gereken hacimleri arasındaki aralık olacağını varsayabiliriz. metal ayrı. Ve sorunu çözmek, bu hacimleri sırayla bulmaya bağlıdır.
2Fe + 3Cl2 = 2FeCl3
Cu + Cl'2 = CuCl2
n(Cl2) = 1,5n(Fe) = 1,5 10/56 = 0,26 mol;
V(Cl2) = n(Cl2) Vm = 0,26 22,4 = 5,99 ≈ 6 l;
n(Cl'2) = n(Cu) = 10/63,5 = 0,16 mol;
V(Cl'2) = 22,4 · 0,16 = 3,5 l.
Cevap: 3,5 ≤ V(Cl2) ≤ 6 l.
11. Bir sodyum iyodür dihidrat, potasyum iyodür ve magnezyum iyodür karışımının, tüm tuzların kütle fraksiyonlarının eşit olduğu ve tüm tuzların toplam miktarının asitleştirilmiş bir potasyum permanganat çözeltisinin fazlası ile işlenmesi sırasında oluşan iyot kütlesini hesaplayın. maddeler 50.0 mmol'dur.
Çözüm:
Çözümde meydana gelen reaksiyonların denklemlerini yazalım ve katsayıları düzenleyeceğimiz genel yarı reaksiyonları oluşturalım:
10NaI 2H2O + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 28H2O
10KI + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
5MgI2 + 2KMnO4 + 8H2SO4 = 5I2 + 2MnSO4 + 5MgSO4 + K2SO4 + 8H2O
MnO4¯+ 8H+ + 5ē = Mn2+ + 4H2O 2
2I¯− 2ē = I2 5
2 MnO4¯+ 16H+ + 10 I¯= 2 Mn2+ + 5I2 + 8H2O
Karışımın bileşenlerinin kütle kesirlerinin eşitliğinden kütlelerinin de eşit olduğu sonucu çıkar. Onları yanıltmak X Eşitliğe dayalı bir cebirsel denklem oluşturalım:
n1 + n2 + n3 = 50,0 mmol
m1/M(NaI 2H2O) + m2/M(KI) + m3/M(MgI2) = 50,0 mmol
m1 = m2 = m3 = x
x/186 + x/166 + x/278 = 50 10-3 mol
m(I2)1 = 5M(I2) m(NaI2H2O)/10M(NaI2H2O) = (5 254 3,33)/10 186 = 2,27 g;
m(I2)2 = 5M(I2) m(KI)/10M(KI) = (5 254 3,33)/10 166 = 2,55 g;
m (I2)3 = 5M(I2) m(MgI2)/10M(MgI2) = (5 254 3,33)/10 278 = 3,04 g.
Toplam: 7,86 gr.
Cevap: 7,86 gr.
12. Klorun 200 g'lık %5,00'lük hidrojen peroksit çözeltisinden geçirilmesiyle çözeltinin kütlesi 3,9 g arttı. Elde edilen çözeltideki maddelerin kütle kesirlerini hesaplayın.
Çözüm:
Н2О2 + Cl2 = О2 + 2НCl
1. Çözeltideki başlangıç H2O2 miktarını bulun:
n1(H2O2) = m/M(H2O2) = mP-RA ω/ M(H2O2) = 200 0,05/34 =
2. Çözeltideki absorbe edilen klor miktarını şu şekilde alalım: X, o zaman nO2 = x ve çözeltinin kütlesindeki artış emilen klor ve salınan oksijen kütlelerindeki farktan kaynaklanmaktadır:
m(Cl 2) − m(O 2) = Δ m veya x M(Cl 2) − x M(O2) = Δ m;
71x - 32x = 3,9; x = 0,1 mol.
3. Çözeltide kalan madde miktarını hesaplayın:
n2(H2O2)OKSİDİZE = n(Cl2) = 0,1 mol;
ÇÖZELTİDE KALAN n(H2O2) = n1 − n2 = 0,294 − 0,1 = 0,194 mol;
n(HCl) = 2n(Cl2) = 0,2 mol.
4. Ortaya çıkan çözeltideki maddelerin kütle kesirlerini bulun:
ω(H2O2) = n(H2O2) M(H2O2)/ mP-RA = 0,194 34/203,9 %100 = %3,23;
ω(HCl) = n(HCl) M(HCl)/ mP-RA = 0,2 36,5/203,9 %100 = %3,58.
Cevap:ω(H2O2) = %3,23;
ω(НCl) = %3,58.
13. 4,31 g ağırlığındaki manganez (II) bromür tetrahidrat, yeterli hacimde su içerisinde çözüldü. Her iki tuzun molar konsantrasyonları eşit oluncaya kadar elde edilen çözeltiden klor geçirildi. Ne kadar klorun (no.) geçtiğini hesaplayın.
Çözüm:
Mn Br2 4H2O + Cl2 = MnCl2 + Br2 + 4H2O
1. Çözeltideki manganez (II) bromür tetrahidratın başlangıç miktarını bulun:
n(Mn Br2 · 4H2O)REQ. = m/M = 4,31/287 = 1,5 10−2 mol.
2. Mn Br2 · 4H2O'nun başlangıçtaki miktarının yarısı tüketildiğinde her iki tuzun molar konsantrasyonlarının eşitliği meydana gelecektir. O. Gerekli klor miktarı reaksiyon denkleminden bulunabilir:
n(Cl2) = n(MnCl2) = 0,5 n(Mn Br2 · 4H2O) ref. = 7,5·10−3mol.
V(Cl2) = n·Vm = 7,5·10−3·22,4 = 0,168 l.
Cevap: 0,168 l.
14. Klor, her iki tuzun kütle payları eşit oluncaya kadar, molar tuz konsantrasyonu 0,05 mol/1 olan 150 ml baryum bromür çözeltisinden geçirildi. Ne kadar klorun (200C, 95 kPa) geçtiğini hesaplayın.
Çözüm:
BaBr2 + Cl2 = BaCl2 + Br2
1. Oluşan tuzların kütle kesirlerinin eşitliğinden kütlelerinin eşitliği çıkar.
m(BaCl2) = m(BaBr2) veya n(BaCl2) M(BaCl2) = n'(BaBr2) M(BaBr2).
2. n(BaCl2)’yi şu şekilde alalım: X SM ·V − x = 0,15·0,05− x = 7,5·10−3− x için mol ve n′(BaBr2) çözümde kalarak cebirsel bir denklem oluşturun:
208x = (7,5 10−3− x) 297;
2,2275 = 297x +208x;
3. Klor miktarını ve hacmini bulun:
n(Cl2) = n(BaCl2) = 0,0044 mol;
V(Cl2) = nRT/P = (0,0044 8,314 293)/95 = 0,113 l.
Cevap: 113ml.
15. Toplam kütlesi 100 g olan bir potasyum bromür ve florür karışımı su içinde çözüldü; elde edilen çözeltiden fazla klor geçirildi. Buharlaştırma ve kalsinasyondan sonra artığın kütlesi 80,0 g'dır. Elde edilen karışımdaki maddelerin kütle fraksiyonlarını hesaplayın.
Çözüm:
1. Reaksiyon ürünlerinin kalsinasyonundan sonra kalıntı potasyum florür ve klorürden oluşur:
2КBr + Cl2 = 2КCl + Br2
2. KF ve KBr miktarlarını şu şekilde alalım: X Ve en buna göre, o zaman
n(KCl) = n(KBr) = y mol.
Eşitliklere dayalı bir denklem sistemi oluşturalım:
m(KF) + m(KBr) = 100
m(KF) + m(KCl) = 80
n(KF) M(KF) + n(KBr) M(KBr) = 100
n(KF) M(KF) + n(KCl) M(KCl) = 80
58x + 119y = 100 58x = 100 – 119y
58 x + 74,5y = 80 100 – 119y + 74,5y = 80
44,5y = 20; y = 0,45; x = 0,8.
3. Kalıntıdaki maddelerin kütlelerini ve kütle kesirlerini bulalım:
m(KF) = 58·0,8 = 46,5 gr.
m(KCl) = 74,5 0,45 = 33,5 gr.
ω(KF) = %46,5/80·100 = %58,1;
ω(KCl) = %33,5/80·100 = %41,9.
Cevap:ω(KF) = %58,1;
ω(КCl) = %41,9.
16. Sodyum bromür ve iyodürden oluşan bir karışım, fazla klorlu su ile işlendi, elde edilen çözelti buharlaştırıldı ve kalsine edildi. Kuru artığın kütlesinin, orijinal karışımın kütlesinden 2.363 kat daha az olduğu ortaya çıktı. Aynı karışımın gümüş nitrat fazlası ile işlenmesinden sonra elde edilen çökeltinin kütlesi, orijinal karışımın kütlesinden kaç kat daha büyük olacaktır?
Çözüm:
2NaBr + HClO +HCl = 2NaCl + Br2 + H2O
2NaI + HClO +HCl = 2NaCl + I2 + H2O
1. Başlangıç karışımının kütlesini 100 g, onu oluşturan NaBr ve NaI tuzlarının miktarlarını ise şöyle alalım: X Ve en sırasıyla. Daha sonra (m(NaBr) + m(NaI))/ m(NaCl) = 2,363 oranına dayanarak bir denklem sistemi oluştururuz:
103x + 150y = 100
2,363·58,5(x+y) = 100
x = 0,54 mol; y = 0,18 mol.
2. İkinci grup reaksiyonları yazalım:
NaBr + AgNO3 = AgBr↓ + NaNO3
NaI + AgNO3 = AgI↓ + NaNO3
Daha sonra, oluşan çökeltinin kütlelerinin ve ilk madde karışımının (100 g olarak alınan) oranını belirlemek için, n(NaBr) ve n('ye eşit olan AgBr ve AgI miktarlarını ve kütlelerini bulmak kalır. NaI), sırasıyla 0,18 ve 0,54 mol.
3. Kütle oranını bulun:
(m(AgBr) + m(AgI))/(m(NaBr) + m(NaI)) =
(M(AgBr) x + M(AgI) y)/100 =
(188 0,18 + 235 0,54)/100 =
(126,9 + 34,67)/100 = 1,62.
Cevap: 1,62 kat.
17. Magnezyum iyodür ve çinko iyodürden oluşan bir karışım, fazla bromlu su ile işlendi, elde edilen çözelti buharlaştırıldı ve 200 - 300°C'de kalsine edildi. Kuru artığın kütlesinin, orijinal karışımın kütlesinden 1.445 kat daha az olduğu ortaya çıktı. Aynı karışımın fazla sodyum karbonatla işlenmesinden sonra elde edilen çökeltinin kütlesi, orijinal karışımın kütlesinden kaç kat daha az olacaktır?
Çözüm:
1. Maddelerin ilk karışımının ve sonuçta ortaya çıkan ürünlerin kütlelerini m1, m2, m3 olarak belirterek her iki reaksiyon grubunu da yazalım.
(MgI2 + ZnI2)+ 2Br2 = (MgBr2 + ZnBr2)+ 2I2
(MgI2 + ZnI2)+ 2 Na2CO3 = (MgCO3 + ZnCO3)↓ + 4NaI
m1/ m2 = 1,445; m1/ m3 = ?
2. Başlangıç karışımındaki tuz miktarını şu şekilde alalım: X(MgI2) ve en(ZnI2) ise, tüm reaksiyonların ürün miktarları şu şekilde ifade edilebilir:
n(MgI2) = n(MgBr2) = n(MgCO3) = x mol;
n(ZnI2) = n(ZnBr2) = n(ZnCO3) = y mol.
Alkali metaller metal olmayanlarla kolayca reaksiyona girer:
2K + I2 = 2KI
2Na + H2 = 2NaH
6Li + N2 = 2Li3N (reaksiyon oda sıcaklığında meydana gelir)
2Na + S = Na2S
2Na + 2C = Na2C2
Oksijenle reaksiyonlarda her alkali metal kendi bireyselliğini gösterir: lityum havada yandığında bir oksit, sodyum peroksit, potasyum süperoksit oluşturur.
4Li + Ö2 = 2Li2Ö
2Na + O2 = Na202
K + Ö2 = KO2
Sodyum oksitin hazırlanması:
10Na + 2NaNO3 = 6Na20 + N2
2Na + Na202 = 2Na20
2Na + 2NaON = 2Na20 + H2
Su ile etkileşimi alkali ve hidrojen oluşumuna yol açar.
2Na + 2H2O = 2NaOH + H2
Asitlerle etkileşim:
2Na + 2HCl = 2NaCl + H2
8Na + 5H2S04 (kons.) = 4Na2S04 + H2S + 4H2O
2Li + 3H 2 SO 4 (kons.) = 2LiHSO 4 + SO 2 + 2H 2 O
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
Amonyakla etkileşime girdiğinde amidler ve hidrojen oluşur:
2Li + 2NH3 = 2LiNH2 + H2
Organik bileşiklerle etkileşim:
H ─ C ≡ C ─ H + 2Na → Na ─ C≡C ─ Na + H 2
2CH3Cl + 2Na → C2H6 + 2NaCl
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
2CH3OH + 2Na → 2 CH3ONa + H2
2СH3 COOH + 2Na → 2CH3 COOOONa + H2
Alkali metallere kalitatif bir reaksiyon, alevin katyonları tarafından renklendirilmesidir. Li + iyonu alevi karmin kırmızısına, Na + iyonu - sarıya, K + - mora boyar.
Alkali metal bileşikleri
Oksitler.
Alkali metal oksitler tipik bazik oksitlerdir. Asidik ve amfoterik oksitler, asitler ve su ile reaksiyona girerler.
3Na 2 Ö + P 2 Ö 5 = 2Na 3 PO 4
Na 2 Ö + Al 2 Ö 3 = 2NaAlO 2
Na20 + 2HCl = 2NaCl + H20
Na 2 O + 2H + = 2Na + + H 2 O
Na20 + H20 = 2NaOH
Peroksitler.
2Na202 + C02 = 2Na2C03 + O2
Na202 + CO = Na2C03
Na 2 Ö 2 + S0 2 = Na 2 S0 4
2Na 2 Ö + Ö 2 = 2Na 2 Ö 2
Na 2 O + NO + NO 2 = 2NaNO 2
2Na 2 Ö 2 = 2 Na 2 Ö + Ö 2
Na202 + 2H20 (soğuk) = 2NaOH + H202
2Na202 + 2H20 (hor.) = 4NaOH + O2
Na202 + 2HCl = 2NaCl + H202
2Na 2 O 2 + 2H 2 SO 4 (bölünmüş ufuk) = 2Na 2 SO 4 + 2H 2 O + O 2
2Na202 + S = Na2S03 + Na20
5Na 2 O 2 + 8H 2 SO 4 + 2KMnO 4 = 5O 2 + 2MnS04 + 8H 2 O + 5Na 2 SO 4 + K 2 SO 4
Na 2 O 2 + 2H 2 SO 4 + 2NaI = I 2 + 2Na 2 SO 4 + 2H 2 O
Na 2 O 2 + 2H 2 SO 4 + 2 FeS04 = Fe 2 (SO 4) 3 + Na 2 SO 4 + 2H 2 O
3Na202 + 2Na3 = 2Na2CrO4 + 8NaOH + 2H20
Bazlar (alkaliler).
2NaOH (fazla) + C02 = Na2C03 + H20
NaOH + C02 (fazla) = NaHC03
S02 + 2NaOH (fazla) = Na2S03 + H20
SiO2 + 2NaOH Na2SiO3 + H20
2NaOH + Al203 2NaAlO2 + H20
2NaOH + Al203 + 3H20 = 2Na
NaOH + Al(OH)3 = Na
2NaOH + 2Al + 6H20 = 2Na + 3H2
2KOH + 2NO2 + O2 = 2KNO3 + H2O
KOH + KHCO3 = K2C03 + H20
2NaOH + Si + H20 = Na2Si03 + H2
3KOH + P4 + 3H20 = 3KH2PO2 + PH3
2KOH (soğuk) + Cl2 = KClO + KCl + H20
6KOH (sıcak) + 3Cl2 = KClO3 + 5KCl + 3H20
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
2NaNO3 2NaNO2 + O2
NaHC03 + HNO3 = NaNO3 + C02 + H20
NaI → Na ++ I –
katotta: 2H 2 O + 2e → H 2 + 2OH – 1
anotta: 2I – – 2e → I 2 1
2H 2 Ö + 2I – ![]() H 2 + 2OH – + I 2
H 2 + 2OH – + I 2
2H2O + 2NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2NaCl ![]() 2Na + Cl2
2Na + Cl2
anottaki katotta
4KClO 3 KCl + 3KClO 4
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Na2S03 + S = Na2S203
2NaI + Br2 = 2NaBr + I2
2NaBr + Cl2 = 2NaCl + Br2
Ben bir grup.
1. Bir şişeye dökülen kostik soda çözeltisinin yüzeyinden elektrik deşarjları geçirildi ve şişedeki hava kahverengiye döndü ve bir süre sonra kayboldu. Nihai çözelti dikkatlice buharlaştırıldı ve katı tortunun, iki tuzun bir karışımı olduğu belirlendi. Bu karışım ısıtıldığında gaz açığa çıkar ve geriye tek madde kalır. Tanımlanan reaksiyonların denklemlerini yazın.
2. Erimiş sodyum klorürün elektrolizi sırasında katotta açığa çıkan madde oksijende yandı. Ortaya çıkan ürün, karbondioksitle dolu bir gazometreye yerleştirildi. Nihai madde, amonyum klorür çözeltisine ilave edildi ve çözelti ısıtıldı. Tanımlanan reaksiyonların denklemlerini yazın.
3) Nitrik asit kabartma tozu ile nötrleştirildi, nötr çözelti dikkatlice buharlaştırıldı ve tortu kalsine edildi. Elde edilen madde, sülfürik asitle asitleştirilmiş bir potasyum permanganat çözeltisine ilave edildi ve çözelti renksiz hale geldi. Nitrojen içeren reaksiyon ürünü, bir sodyum hidroksit çözeltisine yerleştirildi ve çinko tozu ilave edildi ve keskin kokulu bir gaz açığa çıktı. Tanımlanan reaksiyonların denklemlerini yazın.
4) Bir sodyum iyodür çözeltisinin inert elektrotlarla elektrolizi sırasında anotta elde edilen madde potasyum ile reaksiyona sokuldu. Reaksiyon ürünü, konsantre sülfürik asit ile ısıtıldı ve serbest kalan gaz, sıcak bir potasyum kromat çözeltisinden geçirildi. Tanımlanan reaksiyonların denklemlerini yazın
5) Erimiş sodyum klorürün elektrolizi sırasında katotta elde edilen madde oksijende yakıldı. Ortaya çıkan ürün sırasıyla kükürt dioksit ve bir baryum hidroksit çözeltisi ile işlendi. Tanımlanan reaksiyonların denklemlerini yazın
6) Beyaz fosfor, bir potasyum hidroksit çözeltisi içinde çözünerek, havada kendiliğinden tutuşan, sarımsak kokusuna sahip bir gaz açığa çıkarır. Yanma reaksiyonunun katı ürünü, elde edilen beyaz maddenin bir hidrojen atomu içereceği bir oranda kostik soda ile reaksiyona girdi; ikinci madde kalsine edildiğinde sodyum pirofosfat oluşur. Tanımlanan reaksiyonların denklemlerini yazın
7) Bilinmeyen bir metal oksijenle yakıldı. Reaksiyon ürünü karbondioksit ile etkileşime girerek iki madde oluşturur: hidroklorik asit çözeltisiyle reaksiyona girerek karbon dioksit açığa çıkaran bir katı ve yanmayı destekleyen gaz halindeki basit bir madde. Tanımlanan reaksiyonların denklemlerini yazın.
8) Kahverengi gaz, büyük miktarda havanın varlığında aşırı miktarda kostik potasyum çözeltisinden geçirildi. Ortaya çıkan çözeltiye magnezyum talaşları eklenip ısıtıldı ve ortaya çıkan gaz, nitrik asidi nötralize etti. Nihai çözelti dikkatlice buharlaştırıldı ve katı reaksiyon ürünü kalsine edildi. Tanımlanan reaksiyonların denklemlerini yazın.
9) A tuzunun manganez dioksit varlığında termal ayrışması sırasında ikili tuz B ve yanmayı destekleyen ve havanın bir parçası olan bir gaz oluştu; Bu tuz katalizör olmadan ısıtıldığında B tuzu ve daha yüksek oksijen içeren bir asitin tuzu oluşur. A tuzu hidroklorik asitle etkileşime girdiğinde sarı-yeşil bir gaz (basit bir madde) açığa çıkar ve B tuzu oluşur, B tuzu alevi mora çevirir ve bir gümüş nitrat çözeltisiyle etkileşime girdiğinde beyaz bir çökelti oluşur.
Tanımlanan reaksiyonların denklemlerini yazın.
11) Sofra tuzu konsantre sülfürik asitle işlendi. Nihai tuz, sodyum hidroksit ile işleme tabi tutuldu. Ortaya çıkan ürün, fazla kömürle kalsine edildi. Açığa çıkan gaz, bir katalizör varlığında klor ile reaksiyona girdi. Tanımlanan reaksiyonların denklemlerini yazın.
12) Sodyum hidrojenle reaksiyona girdi. Reaksiyon ürünü, klor ile reaksiyona giren bir gaz oluşturan su içinde çözüldü ve elde edilen çözelti, ısıtıldığında klor ile reaksiyona girerek iki tuzdan oluşan bir karışım oluşturdu. Tanımlanan reaksiyonların denklemlerini yazın.
13) Sodyum fazla oksijenle yakıldı, elde edilen kristalli madde bir cam tüpe yerleştirildi ve içinden karbondioksit geçirildi. Tüpten çıkan gaz toplanarak atmosferindeki fosfor yakıldı. Nihai madde, fazla miktarda sodyum hidroksit çözeltisi ile nötrleştirildi. Tanımlanan reaksiyonların denklemlerini yazın.
14) Sodyum peroksitin su ile reaksiyona sokulmasıyla elde edilen çözeltiye, reaksiyon tamamlanıncaya kadar ısıtıldığında hidroklorik asit çözeltisi ilave edildi. Elde edilen tuzun çözeltisi inert elektrotlarla elektrolize tabi tutuldu. Anotta elektroliz sonucu oluşan gaz, bir kalsiyum hidroksit süspansiyonundan geçirildi. Tanımlanan reaksiyonların denklemlerini yazın.
15) Kükürt dioksit, orta düzeyde bir tuz oluşana kadar bir sodyum hidroksit çözeltisinden geçirildi. Ortaya çıkan çözeltiye sulu bir potasyum permanganat çözeltisi ilave edildi. Ortaya çıkan çökelti ayrıldı ve hidroklorik asitle işlendi. Açığa çıkan gaz, soğuk bir potasyum hidroksit çözeltisinden geçirildi. Tanımlanan reaksiyonların denklemlerini yazın.
16) Silikon (IV) oksit ve magnezyum metalinden oluşan bir karışım kalsine edildi. Reaksiyon sonucunda elde edilen basit madde, konsantre bir sodyum hidroksit çözeltisi ile işlendi. Açığa çıkan gaz ısıtılmış sodyumun üzerinden geçirildi. Ortaya çıkan madde suya yerleştirildi. Tanımlanan reaksiyonların denklemlerini yazın.
17) Lityumun nitrojenle reaksiyonunun ürünü su ile işlendi. Ortaya çıkan gaz, kimyasal reaksiyonlar durana kadar bir sülfürik asit çözeltisinden geçirildi. Nihai çözelti, bir baryum klorür çözeltisi ile işlendi. Çözelti süzüldü ve süzüntü, sodyum nitrat çözeltisiyle karıştırıldı ve ısıtıldı. Tanımlanan reaksiyonların denklemlerini yazın.
18) Sodyum hidrojen atmosferinde ısıtıldı. Ortaya çıkan maddeye su eklendiğinde gaz çıkışı ve berrak bir çözelti oluşumu gözlendi. Bakırın konsantre nitrik asit çözeltisi ile etkileşimi sonucu elde edilen bu çözeltiden kahverengi gaz geçirildi. Tanımlanan reaksiyonların denklemlerini yazın.
19) Sodyum bikarbonat kalsine edildi. Ortaya çıkan tuz, su içinde eritildi ve bir alüminyum çözeltisi ile karıştırılarak bir çökelti oluştu ve renksiz bir gaz açığa çıktı. Çökelti fazla miktarda nitrik asit çözeltisi ile işlendi ve gaz, bir potasyum silikat çözeltisinden geçirildi. Tanımlanan reaksiyonların denklemlerini yazın.
20) Sodyum kükürt ile kaynaştı. Nihai bileşik, hidroklorik asit ile işlendi; açığa çıkan gaz, sülfür oksit (IV) ile tamamen reaksiyona girdi. Ortaya çıkan madde konsantre nitrik asit ile işleme tabi tutuldu. Tanımlanan reaksiyonların denklemlerini yazın.
21) Sodyum fazla oksijenle yakılır. Ortaya çıkan madde su ile işlendi. Nihai karışım kaynatıldı ve ardından sıcak çözeltiye klor ilave edildi. Tanımlanan reaksiyonların denklemlerini yazın.
22) Potasyum nitrojen atmosferinde ısıtıldı. Nihai madde, fazla miktarda hidroklorik asit ile işlendi, ardından elde edilen tuz karışımına bir kalsiyum hidroksit süspansiyonu ilave edildi ve ısıtıldı. Elde edilen gaz sıcak bakır (II) oksitten geçirildi. Tanımlanan reaksiyonların denklemlerini yazın.
23) Potasyum bir klor atmosferinde yakıldı, elde edilen tuz, fazla miktarda sulu gümüş nitrat çözeltisi ile işlendi. Oluşan çökelti süzüldü, süzüntü buharlaştırıldı ve dikkatlice ısıtıldı. Nihai tuz, sulu bir brom çözeltisi ile işleme tabi tutuldu. Tanımlanan reaksiyonların denklemlerini yazın.
24) Lityum hidrojenle reaksiyona girdi. Reaksiyon ürünü, brom ile reaksiyona giren bir gaz oluşturan su içinde çözüldü ve elde edilen çözelti, ısıtıldığında klor ile reaksiyona girerek iki tuzun bir karışımını oluşturdu. Tanımlanan reaksiyonların denklemlerini yazın.
25) Sodyum havada yandı. Ortaya çıkan katı karbondioksiti emerek oksijen ve tuzu serbest bırakır. Son tuz hidroklorik asit içinde çözüldü ve elde edilen çözeltiye bir gümüş nitrat çözeltisi ilave edildi. Beyaz bir çökelti oluştu. Tanımlanan reaksiyonların denklemlerini yazın.
26) Oksijen bir ozonlayıcıda elektrik deşarjına maruz bırakıldı. Ortaya çıkan gaz, sulu bir potasyum iyodür çözeltisinden geçirildi ve yanmayı ve solunumu destekleyen, renksiz ve kokusuz yeni bir gaz açığa çıktı. İkinci gazın atmosferinde sodyum yakıldı ve ortaya çıkan katı, karbondioksit ile reaksiyona girdi. Tanımlanan reaksiyonların denklemlerini yazın.
Ben bir grup.
1. N2 + Ö2 ![]() 2Hayır
2Hayır
2NO + Ö2 = 2NO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H20
2NaNO3 2NaNO2 + O2
2.2NaCl ![]() 2Na + Cl2
2Na + Cl2
anottaki katotta
2Na + O2 = Na202
Na2C03 + 2NH4Cl = 2NaCl + C02 + 2NH3 + H20
3. NaHC03 + HNO3 = NaNO3 + C02 + H20
2NaNO3 2NaNO2 + O2
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
NaNO3 + 4Zn + 7NaOH + 6H20 = 4Na2 + NH3
4. 2H2O + 2NaI ![]() H2 + 2NaOH + I2
H2 + 2NaOH + I2
2K + I2 = 2KI
8KI + 5H 2 SO 4 (kons.) = 4K 2 SO 4 + H 2 S + 4I 2 + 4H 2 O
3H 2 S + 2K 2 CrO 4 + 2H 2 O = 2Cr(OH) 3 ↓ + 3S↓ + 4KOH
5. 2NaCl ![]() 2Na + Cl2
2Na + Cl2
anottaki katotta
2Na + O2 = Na202
Na 2 Ö 2 + S0 2 = Na 2 S0 4
Na2S04 + Ba(OH)2 = BaS04 ↓ + 2NaOH
6. P4 + 3KOH + 3H20 = 3KH2PO2 + PH3
2PH3 + 4O2 = P205 + 3H20
P205 + 4NaOH = 2Na2HPO4 + H20
2Na 2 HPO 4 Na 4 P 2 O 7 + H 2 O
7. 2Na + O2 Na202
2Na202 + 2CO2 = 2Na2C03 + O2
C + O2 = C02
8. 2KOH + 2N02 + O2 = 2KNO3 + H20
KNO3 + 4Mg + 6H20 = NH3 + 4Mg(OH)2 + KOH
NH3 + HNO3 = NH4NO3
NH 4 NO 3 N 2 O + 2H 2 O (190 – 245°C)
2NH 4 NO 3 2NO + N 2 + 4H 2 O (250 – 300°C)
2NH 4 NO 3 2N 2 + O 2 + 4H 2 O (300°C'nin üstünde)
9. 2KClO3 2KCl + 3O2
4KClO 3 KCl + 3KClO 4
KClO3 + 6HCl = KCl + 3Cl2 + 3H20
KCl + AgNO3 = AgCl↓ + KNO3
10. 2H2S04 (kons.) + Cu = CuS04 + SO2 + 2H20
S02 + 2NaOH = Na2S03 + H20
Na2S03 + S = Na2S203
Na 2 S 2 Ö 3 + H 2 SO 4 = Na 2 SO 4 + S↓ + SO 2 + H 2 O
11. NaCl (katı) + H2S04 (kons.) = NaHSO4 + HCl
NaHSO4 + NaOH = Na2S04 + H20
Na 2 SO 4 + 4C Na 2 S + 4CO
CO+Cl2 ![]() COCl2
COCl2
12) 2Na + H2 = 2NaH
NaH + H20 = NaOH + H2
H2 + Cl2 = 2HCl
6NaOH + 3Cl2 = NaClO3 + 5NaCl + 3H2O
13) 2Na + O2 = Na202
2Na202 + 2CO2 = 2Na2C03 + O2
4P + 5O 2 = 2P 2 Ey 5
P205 + 6NaOH = 2Na3P04 + 3H20
14) 2Na202 + 2H20 = 4NaOH + O2
NaOH + HCl = NaCl + H2O
2H2O + 2NaCl ![]() H2 + 2NaOH + Cl2
H2 + 2NaOH + Cl2
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H20
15) 2NaOH + S02 = Na2S03 + H20
3Na2S03 + 2KMnO4 + H2O = 3Na2S04 + 2MnO2 + 2KOH
MnO2 + 4HCl = MnCl2 + Cl2 + 2H20
2NaOH (soğuk) + Cl2 = NaCl + NaClO + H20
16) SiO2 + 2Mg = 2MgO + Si
2NaOH + Si + H20 = Na2Si03 + 2H2
2Na + H2 = 2NaH
NaH + H20 = NaOH + H2
17) 6Li + N2 = 2Li3N
Li3N + 3H20 = 3LiOH + NH3
2NH3 + H2S04 = (NH4)2S04
(NH4)2S04 + BaCl2 = BaS04 + 2NH4Cl
18) 2Na + H2 = 2NaH
NaH + H20 = NaOH + H2
Cu + 4HNO3(kons.) = Cu(NO3)2 + 2NO2 + 2H2O
2NaOH + 2NO2 = NaNO3 + NaNO2 + H2O
19) 2NaHC03 Na2C03 + C02 + H20
3Na2C03 + 2AlBr3 + 3H20 = 2Al(OH)3 ↓ + 3CO2 + 6NaBr
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H20
K 2 SiO 3 + 2CO 2 + 2H 2 O = 2КHCO 3 + H 2 SiO 3 ↓
20) 2Na + S = Na2S
Na2S + 2HCl = 2NaCl + H2S
S02 + 2H2S = 3S + 2H20
S + 6HNO3 = H2S04 + 6NO2 + 2H2O
21) 2Na + O2 = Na202
Na202 + 2H20 = 2NaOH + H202
2H 2 Ö 2 2H 2 Ö + Ö 2
6NaOH (hor.) + 3Cl2 = NaClO3 + 5NaCl + 3H20
22) 6K + N 2 = 2K 3 N
K3N + 4HCl = 3KCl + NH4Cl
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H20
2NH3 + 3CuO = N2 + 3Cu + 3H2O
23) 2K + Cl2 = 2KCl
KCl + AgNO3 = KNO3 + AgCl↓
2KNO 3 2KNO 2 + Ç 2
KNO 2 + Br 2 + H 2 Ö = KNO 3 + 2HBr
24) 2Li + H2 = 2LiH
LiH + H20 = LiOH + H2
H2 + Br2 = 2HBr
6LiOH (hor.) + 3Cl2 = LiClO3 + 5LiCl + 3H20
25) 2Na + O2 = Na202
2Na202 + 2CO2 = 2Na2C03 + O2
Na2C03 + 2HCl = 2NaCl + C02 + H20
NaCl + AgNO3 = AgCl↓ + NaNO3
26) 3O2 ↔2O3
Ö3 + 2KI + H2Ö = I2 + Ö2 + 2KOH
2Na + O2 = Na202
2Na202 + 2CO2 = 2Na2C03 + O2
Kimya öğretmeni
DERS 10
10. sınıf(eğitimin ilk yılı)
Devam. Başlangıç için bkz. No. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11/2006
Redoks reaksiyonları
Planı
1. Yükseltgenme-indirgeme reaksiyonları (ORR), oksidasyonun derecesi.
2. Oksidasyon prosesinde en önemli indirgeyici ajanlar.
3. İndirgeme işleminde en önemli oksitleyici maddeler.
4. Redoks ikiliği.
5. Ana ORR türleri (moleküller arası, moleküller arası, orantısızlık).
6. ORR değeri.
7. ORR denklemlerini derleme yöntemleri (elektronik ve elektron-iyon dengesi).
İlgili atomların oksidasyon durumlarındaki değişikliklere dayanan tüm kimyasal reaksiyonlar iki türe ayrılabilir: ORR (oksidasyon durumlarında bir değişiklikle meydana gelenler) ve ORR olmayan.
Oksidasyon durumu– bir moleküldeki bir atomun, molekülde yalnızca iyonik bağların mevcut olduğu varsayımına dayanarak hesaplanan koşullu yükü.
Oksidasyon derecesini belirleme kuralları
Basit maddelerin atomlarının oksidasyon durumu sıfırdır.
Karmaşık bir maddedeki (bir moleküldeki) atomların oksidasyon durumlarının toplamı sıfırdır.
Alkali metal atomlarının oksidasyon durumu +1'dir.
Alkali toprak metal atomlarının oksidasyon durumu +2'dir.
Bor ve alüminyum atomlarının oksidasyon durumu +3'tür.
Hidrojen atomlarının oksidasyon durumu +1'dir (alkali ve alkali toprak metallerinin hidritlerinde –1).
Oksijen atomlarının oksidasyon durumu –2'dir (peroksitlerde –1).
Herhangi bir ORR, bir dizi elektron bağışı ve eklenmesi sürecidir.
Elektron verme işlemine denir oksidasyon. Elektron veren parçacıklara (atom, molekül veya iyon) denir. restoratörler. Oksidasyonun bir sonucu olarak indirgeyici maddenin oksidasyon durumu artar. İndirgeyici maddeler, düşük veya orta oksidasyon durumlarında parçacıklar olabilir. En önemli indirgeyici maddeler şunlardır: Basit maddeler formundaki tüm metaller, özellikle aktif olanlar; C, CO, NH3, PH3, CH4, SiH4, H2S ve sülfürler, hidrojen halojenürler ve metal halojenürler, metal hidritler, metal nitrürler ve fosfitler.
Elektron ekleme işlemine denir restorasyon. Elektron kabul eden parçacıklara denir oksitleyici maddeler.İndirgemenin bir sonucu olarak, oksitleyici maddenin oksidasyon durumu azalır. Oksitleyici maddeler, daha yüksek veya orta oksidasyon durumlarında parçacıklar olabilir. En önemli oksitleyici maddeler: yüksek elektronegatifliğe sahip basit metal olmayan maddeler (F2, Cl2, O2), potasyum permanganat, kromatlar ve dikromatlar, nitrik asit ve nitratlar, konsantre sülfürik asit, perklorik asit ve perkloratlar.
Üç tür redoks reaksiyonu vardır.
Moleküller arası OVR - çeşitli maddelere bir oksitleyici madde ve bir indirgeyici madde dahildir, örneğin:

Molekül içi OVR – bir oksitleyici madde ve bir indirgeyici madde aynı maddenin parçasıdır.

Bunlar farklı unsurlar olabilir, örneğin:

veya farklı oksidasyon durumlarındaki bir kimyasal element, örneğin: Orantısızlık (oto-oksidasyon-kendi kendini iyileştirme)

– oksitleyici madde ve indirgeyici madde, ara oksidasyon durumunda olan aynı elementtir, örneğin:

Doğada meydana gelen reaksiyonların çoğu (fotosentez süreci, yanma) bu türe ait olduğundan ORR'ler büyük önem taşımaktadır. Ek olarak, ORR'ler insanlar tarafından pratik faaliyetlerinde (metallerin indirgenmesi, amonyak sentezi) aktif olarak kullanılmaktadır:
ORR denklemlerini derlemek için elektronik denge (elektronik devreler) yöntemini veya elektron-iyon dengesi yöntemini kullanabilirsiniz.
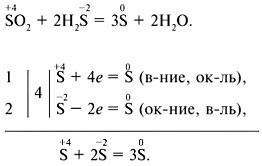
Elektronik denge yöntemi:

Elektron-iyon dengesi yöntemi:
“Yükseltgenme-indirgeme reaksiyonları” konulu test
1. Potasyum dikromat, bir sülfürik asit çözeltisi içinde kükürt dioksit ile ve ardından sulu bir potasyum sülfür çözeltisi ile işlendi. Nihai madde X:
a) potasyum kromat; b) krom(III) oksit;
2. c) krom(III) hidroksit; d) krom(III) sülfür.
Potasyum permanganat ve hidrobromik asit arasındaki hangi reaksiyon ürünü hidrojen sülfit ile reaksiyona girebilir?
a) Brom; b) manganez(II) bromür;
3. Demir(II) iyodürün nitrik asitle oksidasyonu, iyot ve nitrojen monoksit üretir. Bu reaksiyonun denkleminde oksitleyici maddenin katsayısının indirgeyici maddenin katsayısına oranı nedir?
a) 4:1; b) 8:3; c) 1:1; d) 2:3.
4. Bikarbonat iyonundaki karbon atomunun oksidasyon durumu şuna eşittir:
a) +2; b) –2; c) +4; +5.
5. Nötr bir ortamda potasyum permanganat aşağıdakilere indirgenir:
a) manganez; b) manganez(II) oksit;
c) manganez(IV) oksit; d) potasyum manganat.
6. Manganez dioksitin konsantre hidroklorik asit ile reaksiyonuna ilişkin denklemdeki katsayıların toplamı şuna eşittir:
a) 14; b) 10; c) 6; 9.
7. Listelenen bileşiklerden yalnızca aşağıdakiler oksitleyici yetenek sergiler:
a) sülfürik asit; b) sülfürik asit;
c) hidrosülfit asit; d) potasyum sülfat.
8. Listelenen bileşiklerden redoks dualitesi şu şekilde sergilenir:
a) hidrojen peroksit; b) sodyum peroksit;
c) sodyum sülfit; d) sodyum sülfür.
9. Aşağıdaki reaksiyon türlerinden redoks reaksiyonları şunlardır:
a) nötrleştirme; b) restorasyon;
c) orantısızlık; d) takas.
10. Bir karbon atomunun oksidasyon durumu, maddedeki değerliliğiyle sayısal olarak örtüşmez:
a) karbon tetraklorür; b) etan;
c) kalsiyum karbür; d) karbon monoksit.
Testin anahtarı
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| V | A | A | V | V | G | a, d | a, b, c | b, c | b, c |
Redoks reaksiyonları üzerine alıştırmalar
(elektronik ve elektron-iyon dengesi)
Görev 1. Elektronik denge yöntemini kullanarak OVR denklemleri oluşturun, OVR türünü belirleyin.
1. Çinko + potasyum dikromat + sülfürik asit = çinko sülfat + krom(III) sülfat + potasyum sülfat + su.
Elektronik denge:

2. Kalay(II) sülfat + potasyum permanganat + sülfürik asit = kalay(IV) sülfat + manganez sülfat + potasyum sülfat + su.
3. Sodyum iyodür + potasyum permanganat + potasyum hidroksit = iyot + potasyum manganat + sodyum hidroksit.
4. Kükürt + potasyum klorat + su = klor + potasyum sülfat + sülfürik asit.
5. Potasyum iyodür + potasyum permanganat + sülfürik asit = manganez(II) sülfat + iyot + potasyum sülfat + su.
6. Demir(II) sülfat + potasyum dikromat + sülfürik asit = demir(III) sülfat + krom(III) sülfat + potasyum sülfat + su.
7. Amonyum nitrat = nitrik oksit (I) + su.
8. Fosfor + nitrik asit = fosforik asit + nitrik oksit (IV) + su.
9. Nitröz asit = nitrik asit + nitrik oksit (II) + su.
10. Potasyum klorat + hidroklorik asit = klor + potasyum klorür + su.
11. Amonyum dikromat = nitrojen + krom(III) oksit + su.
12. Potasyum hidroksit + klor = potasyum klorür + potasyum klorat + su.
13. Kükürt(IV) oksit + brom + su = sülfürik asit + hidrobromik asit.
14. Kükürt(IV) oksit + hidrojen sülfür = kükürt + su.
15. Sodyum sülfit = sodyum sülfit + sodyum sülfat.
16. Potasyum permanganat + hidroklorik asit = manganez(II) klorür + klor + potasyum klorür + su.
17. Asetilen + oksijen = karbondioksit + su.
18. Potasyum nitrit + potasyum permanganat + sülfürik asit = potasyum nitrat + manganez(II) sülfat + potasyum sülfat + su.
19. Silikon + potasyum hidroksit + su = potasyum silikat + hidrojen.
20. Platin + nitrik asit + hidroklorik asit = platin(IV) klorür + nitrik oksit + su.
21. Arsenik sülfür + nitrik asit = arsenik asit + kükürt dioksit + nitrojen dioksit + su.
22. Potasyum permanganat = potasyum manganat + manganez(IV) oksit + oksijen.
23.
Bakır(I) sülfür + oksijen + kalsiyum karbonat = bakır(II) oksit + kalsiyum sülfit +
+ karbondioksit.
24.
Demir(II) klorür + potasyum permanganat + hidroklorik asit = demir(III) klorür + klor +
+ manganez(II) klorür + potasyum klorür + su.
25. Demir(II) sülfit + potasyum permanganat + sülfürik asit = demir(III) sülfat + manganez(II) sülfat + potasyum sülfat + su.
Görev 1'deki alıştırmaların cevapları


Yarı reaksiyon yöntemini (elektron-iyon dengesi) kullanırken, sulu çözeltilerde fazla oksijenin bağlanmasının ve indirgeyici bir madde tarafından oksijen eklenmesinin asidik, nötr ve alkali ortamlarda farklı şekilde meydana geldiği akılda tutulmalıdır. Asidik çözeltilerde, fazla oksijen protonlar tarafından bağlanarak su molekülleri oluştururken, nötr ve alkali çözeltilerde su molekülleri tarafından hidroksit iyonları oluşturulur. İndirgeyici bir madde ile oksijenin eklenmesi, su molekülleri nedeniyle hidrojen iyonlarının oluşmasıyla asidik ve nötr ortamlarda ve alkali bir ortamda - su moleküllerinin oluşmasıyla hidroksit iyonları nedeniyle gerçekleştirilir.
Nötr ortam:
Alkali ortam:
oksitleyici madde + H 2 O = ... + OH – ,
indirgeyici madde + OH – = ... + H2O.
Asidik ortam:
oksitleyici madde + H + = ... + H2O,
indirgeyici madde + H 2 O = ... + H + .
Görev 2. Elektron-iyon dengesi yöntemini kullanarak belirli bir ortamda meydana gelen redoks reaksiyonları için denklemler oluşturun.
1. Sodyum sülfit + potasyum permanganat + su =..................
2. Demir(II) hidroksit + oksijen + su = ....................................
3. Sodyum bromür + potasyum permanganat + su = ...................................
4. Hidrojen sülfit + brom + su = sülfürik asit + ................................
5. Gümüş(I) nitrat + fosfin + su = gümüş + fosforik asit + ..................................
ALKALİ ORTAMDA
1. Sodyum sülfit + potasyum permanganat + potasyum hidroksit = ....................
2. Potasyum bromit + klor + potasyum hidroksit = potasyum bromat + ..................
3. Manganez(II) sülfat + potasyum klorat + potasyum hidroksit = potasyum manganat + ...................... .
4. Krom(III) klorür + brom + potasyum hidroksit = potasyum kromat + ..................
5. Manganez(IV) oksit + potasyum klorat + potasyum hidroksit = potasyum manganat + ...................... .
Asidik bir ortamda
1. Sodyum sülfit + potasyum permanganat + sülfürik asit = ...................
2. Potasyum nitrit + potasyum iyodür + sülfürik asit = nitrik oksit (II) + ................................
3. Potasyum permanganat + nitrik oksit (II) + sülfürik asit = nitrik oksit (IV) + ...................... .
4. Potasyum iyodür + potasyum bromat + hidroklorik asit = .....................
5. Manganez(II) nitrat + kurşun(IV) oksit + nitrik asit = manganez asit +
+ ...................... .
Görev 2'deki alıştırmaların cevapları
NÖTR A L ÇEVRE

Görev 3. Elektron-iyon dengesi yöntemini kullanarak ORR denklemlerini oluşturun.
1. Manganez(II) hidroksit + klor + potasyum hidroksit = manganez(IV) oksit + ................................. .
Elektron-iyon dengesi:

2. Manganez(IV) oksit + oksijen + potasyum hidroksit = potasyum manganat +.......................
3. Demir(II) sülfat + brom + sülfürik asit = .....................
4. Potasyum iyodür + demir(III) sülfat = .................... .
5. Hidrojen bromür + potasyum permanganat = .................................
6. Hidrojen klorür + krom(VI) oksit = krom(III) klorür + ..................
7. Amonyak + brom =..................
8. Bakır(I) oksit + nitrik asit = nitrik oksit(II) + ...................
9. Potasyum sülfit + potasyum manganat + su = kükürt + ................................
10. Nitrik oksit (IV) + potasyum permanganat + su = .....................
11. Potasyum iyodür + potasyum dikromat + sülfürik asit = ..................................
12. Kurşun(II) sülfür + hidrojen peroksit =.................................
13. Hipokloröz asit + hidrojen peroksit = hidroklorik asit + ................................
14. Potasyum iyodür + hidrojen peroksit = .................................
15. Potasyum permanganat + hidrojen peroksit = manganez(IV) oksit + .....................................
16. Potasyum iyodür + potasyum nitrit + asetik asit = nitrik oksit (II) + .................................... .
17. Potasyum permanganat + potasyum nitrit + sülfürik asit = ..................................
18. Sülfürik asit + klor + su = sülfürik asit + ................................
19. Sülfürik asit + hidrojen sülfür = kükürt + ..................................
Görevler C 2 (2013)
Çeşitli inorganik madde sınıfları arasındaki ilişkiyi doğrulayan reaksiyonlar
Bakır(II) oksit, bir karbon monoksit akışında ısıtıldı. Ortaya çıkan madde klor atmosferinde yakıldı.
Reaksiyon ürünü su içinde çözüldü.
Ortaya çıkan çözüm iki parçaya bölündü. Bir parçaya bir potasyum iyodür çözeltisi, ikinciye bir gümüş nitrat çözeltisi eklendi. Her iki durumda da çökelti oluşumu gözlendi.
Tanımlanan dört reaksiyon için denklemler yazın.
Bakır nitrat kalsine edildi ve elde edilen katı, seyreltik sülfürik asit içerisinde çözüldü. Elde edilen tuzun çözeltisi elektrolize tabi tutuldu. Katotta açığa çıkan madde konsantre nitrik asitte çözüldü.
Çözünme kahverengi gazın salınmasıyla devam etti. Tanımlanan dört reaksiyon için denklemler yazın.
Demir, klor atmosferinde yakıldı. Ortaya çıkan madde, fazla miktarda sodyum hidroksit çözeltisi ile işleme tabi tutuldu. Filtrelenen ve kalsine edilen kahverengi bir çökelti oluştu. Kalsinasyondan sonra kalan kısım hidroiyodik asit içerisinde çözüldü.
Demir klorda yakıldı. Nihai tuz, sodyum karbonat çözeltisine ilave edildi ve kahverengi bir çökelti oluştu. Bu çökelti filtrelendi ve kalsine edildi. Ortaya çıkan madde hidroiyodik asit içerisinde çözüldü. Tanımlanan dört reaksiyon için denklemler yazın.
Bir potasyum iyodür çözeltisi, fazla miktarda klorlu su ile muamele edildi ve önce bir çökelti oluşumu ve ardından tamamen çözünmesi gözlendi. Ortaya çıkan iyot içeren asit çözeltiden izole edildi, kurutuldu ve dikkatlice ısıtıldı.
Ortaya çıkan oksit, karbon monoksit ile reaksiyona girdi. Tanımlanan reaksiyonların denklemlerini yazın.
Krom(III) sülfit tozu, sülfürik asit içerisinde çözüldü. Aynı zamanda gaz açığa çıktı ve renkli bir çözelti oluştu. Ortaya çıkan çözeltiye fazla miktarda amonyak çözeltisi ilave edildi ve gaz, kurşun nitrattan geçirildi. Ortaya çıkan siyah çökelti, hidrojen peroksit ile muameleden sonra beyaza döndü.
Tanımlanan reaksiyonların denklemlerini yazın.
Alüminyum tozu, kükürt tozu ile ısıtıldı ve elde edilen madde, su ile işlendi.
Ortaya çıkan çökelti, tamamen çözünene kadar fazla miktarda konsantre potasyum hidroksit çözeltisi ile işlendi. Ortaya çıkan çözeltiye bir alüminyum klorür çözeltisi ilave edildi ve beyaz bir çökeltinin oluşumu yeniden gözlendi. Tanımlanan reaksiyonların denklemlerini yazın.
Potasyum nitrit ve amonyum klorür tozlarının bir karışımı su içinde çözüldü ve çözelti hafifçe ısıtıldı. Açığa çıkan gaz magnezyum ile reaksiyona girdi. Reaksiyon ürünü, fazla miktarda hidroklorik asit çözeltisine ilave edildi ve herhangi bir gaz oluşumu gözlenmedi.
Çözelti içinde elde edilen magnezyum tuzu, sodyum karbonat ile işleme tabi tutuldu. Tanımlanan reaksiyonların denklemlerini yazın.
Alüminyum oksit, sodyum hidroksit ile kaynaştırıldı.
Reaksiyon ürünü bir amonyum klorür çözeltisine ilave edildi. Açığa çıkan keskin kokulu gaz, sülfürik asit tarafından emilir.
Ortaya çıkan ortam tuzu kalsine edildi. Tanımlanan reaksiyonların denklemlerini yazın.
|
Klor, sıcak bir potasyum hidroksit çözeltisiyle reaksiyona girdi. Çözelti soğudukça Berthollet tuzu kristalleri çökeldi. Nihai kristaller, bir hidroklorik asit çözeltisine ilave edildi. Ortaya çıkan basit madde metalik demir ile reaksiyona girdi. Reaksiyon ürünü yeni bir demir kısmı ile ısıtıldı. Tanımlanan reaksiyonların denklemlerini yazın. Bakır konsantre nitrik asitte çözüldü. Ortaya çıkan çözeltiye, önce bir çökeltinin oluşumunu ve ardından tamamen çözünmesini gözlemleyerek fazla miktarda amonyak çözeltisi eklendi. Nihai çözelti, fazla hidroklorik asit ile işleme tabi tutuldu. Tanımlanan reaksiyonların denklemlerini yazın. Demir, sıcak konsantre sülfürik asit içerisinde çözüldü. Ortaya çıkan tuz, fazla miktarda sodyum hidroksit çözeltisi ile işleme tabi tutuldu. Oluşan kahverengi çökelti süzüldü ve kalsine edildi. Ortaya çıkan madde demir ile kaynaştırıldı. Tanımlanan dört reaksiyon için denklemler yazın. 1)CuO + CO=Cu+CO2 |
2) Cu+Cl2 = CuCl2 3) 2CuCl2 +2KI=2CuCl↓ +I2 +2KCl 4) CuCl2 +2AgNO3 =2AgCl↓+Cu(NO3)2 1)Cu(NO 3) 2 2CuO+4NO 2 +O 2 |
2) CuO+2H2SO4 =CuSO4 +S02 +2H2O 3)CuSO 4 +H 2 O=Cu↓+H 2 SO 4 +O 2 (seçilmiş 4)Cu+4HNO3 =Cu(NO3)2 +2NO2 +2H2O |
|
1) 2Fe + 3Cl2 = 2FeCl3 2)FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl 4)Fe203 + 6HI = 2FeI2 + I2 + 3H20 1) 2Al+3I 2 = 2AlI 3 |
2) AlI3 +3NaOH= Al(OH)3 +3NaI 3)Al(OH)3 + 3HCl= AlCl3 + 3H20 4)2AlCl3 +3Na2C03 +3H20=2Al(OH)3 +3CO2 +6NaCl |
2) Fe203 +CO=Fe+CO2 3)2Fe+6H 2 SO 4 =Fe 2 (SO 4) 3 +3SO 2 +6H 2 O 4)Fe 2 (SO 4) 3 +4H 2 O=2Fe+H 2 +3H 2 SO 4 +O 2 (elektroliz) 1) ZnS+2HNO 3 =Zn(NO 3) 2 +H 2 S |
|
2)2ZnS +3O 2 =2ZnO +2SO 2 3)2H 2 S+S02 =3S↓+2H 2 O 4)S+6HNO3 =H2SO4 +6NO2 +2H2O |
2) CuO+2H2SO4 =CuSO4 +S02 +2H2O 2) FeS + 2H2O=Fe(OH)2 +H2S 3)2H 2 S+3O 2 2SO 2 +2H 2 O 4) Fe203 + 6HI = 2FeI2 + I2 + 3H20 |
1)2KI+Cl2 =2KCl+I2 2)I2 +5Cl2 +6H2O=10HCl+2HIO3 3)2HIO 3 I 2 Ö 5 + H 2 Ö 4) I2O5 +5CO = I2 +5CO2 |
|
1)Cr 2 S 3 +3H 2 SO 4 =Cr 2 (SO 4) 3 +3H 2 S 2)Cr2 (SO 4) 4 +6NH3 +6H 2 O=2Cr(OH) 3 ↓+3(NH 4) 2 SO 4 3)H 2 S+Pb(NO 3) 2 =PbS↓+2HNO 3 4)PbS+4H202 =PbS04 +4H20 |
1)2Al+3S Al 2 S 3 2)Al 2 S 3 +6H 2 O=2Al(OH) 3 ↓+3H 2 S 3)Al(OH)3 +KOH=K 4)3K+AlCl3 =3KCl+Al(OH)3 ↓ |
1)KNO 3 +Pb KNO 2 +PbO 2)2KNO 2 +2H 2 SO 4 +2KI=2K 2 SO 4 + 2NO+I 2 +2H 2 O 3)I 2 +10HNO 3 2HIO 3 +10NO 2 +4H 2 O 4)10HAYIR 2 +P=2P 2 Ç 5 +10HAYIR |
|
1)3Cu+8HNO 3 =3Cu(NO 3) 2 +2NO+4H 2 O 4)(OH)2 +3H2S04 = CuS04 +2(NH4)2S04 + 2H20 |
1)4Mg+10HNO3 = 4Mg(NO3)2 +NH4NO3 + 3H2O 2) Mg(NO 3) 2 +2KOH=Mg(OH) 2 ↓+2KNO 3 3)NH4 NO3 +KOHKNO3 +NH3 +H2O 4)4NH3 +3O2 =2N2 +6H2O |
1)KNO2 +NH4Cl KCl+N2 +2H2O 2) 3Mg+N2 =Mg3N2 3)Mg3N2 +8HCl=3MgCl2 +2NH4Cl 4)2MgCl2 +2Na2C03 +H20= (MgOH)2C03 ↓+ CO2 +4NaCl |
|
1)Al 2 O 3 +2NaOH 2NaAlO 2 +H 2 O 2)NaAlO2 +NH4Cl+H2O=NaCl+ Al(OH)3 ↓+NH3 3)2NH3 +H2S04 =(NH4)2S04 4)(NH4)2SO4NH3+NH4HSO4 |
1)3Cl2 +6KOH6KCl+KClO3 +3H2O 2)6HCl+KClO3 =KCl+3Cl2 +3H20 3)2Fe+3Cl2 =2FeCl3 4)2FeCl3 +Fe3FeCl2 |
1)3Cu+4HNO3 =3Cu(NO3)2 +2NO2 +4H2O 2)Cu(NO3)2 +2NH3H20=Cu(OH)2 + 2NH4NO3 3)Cu(OH)2 +4NH3H20 =(OH)2 + 4H20 4)(OH)2 +6HCl= CuCl2 +4NH4Cl + 2H20 |
|
19 Belge C2 Tepkiler, onaylıyor ilişki çeşitli sınıflar inorganik maddeler Verilen sulu çözeltiler... Olası dört durum için denklem yazın reaksiyonlar. Dans maddeler: hidrobromik asit, ... sırasında çöker reaksiyonlar madde sarı renk yandı... Astrahan bölgesi konu komisyon başkanlarının ortaöğretim genel eğitim eğitim programları için devlet nihai sertifikasyonunun akademik konuları hakkındaki özet raporuRapor4 21,9 40,6 C2 Tepkiler, onaylıyor ilişki çeşitli sınıflar inorganik maddeler 54,1 23,9 9,9 7,7 4,3 C3 Tepkiler, onaylıyor ilişki organik bileşikler 56,8 10 ... 2013–2014 akademik yılında kimyada Birleşik Devlet Sınavına hazırlık derslerinin takvim tematik planlaması KonuTakvim ve tematik planlama25) 27.03.2014 Tepkiler, onaylıyor ilişki çeşitli sınıflar inorganik maddeler. Alıştırmaların çözümü C-2...basit maddeler. Kompleksin kimyasal özellikleri maddeler. İlişki çeşitli sınıflar inorganik maddeler. Tepkiler iyon değişimi... 2015 yılında Barnaul ve Altay Bölgesi'ndeki okul mezunları için Kimyada Birleşik Devlet Sınavına hazırlık için takvim temalı ders planı. Ders numarasıTakvim tematik planı... (alüminyum ve çinko bileşikleri örneğini kullanarak). İlişki inorganik maddeler. Tepkiler, onaylıyor ilişki çeşitli sınıflar inorganik maddeler(37 (C2)). 28 Şubat 2015... |
